ピリジンとは?性質・特徴や用途について紹介
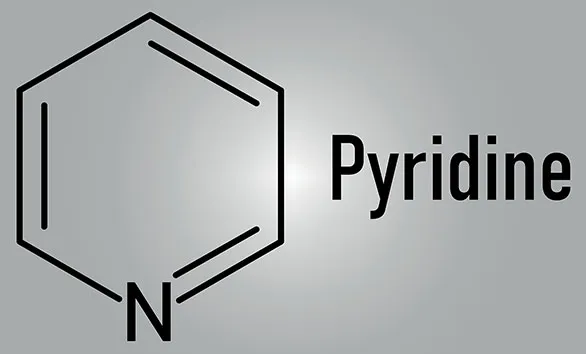
ピリジンとは一体どのような化合物でしょうか?ピリジンの性質や生成方法はもちろん、反応性や危険性を含めて紹介していきます。
また、ピリジンは実際にどのように使用されているのでしょうか。身近に生成されていたり、日頃の私たちの生活にも役に立っていることもあります。
ピリジンとは
ピリジン(pyridine)は分子量79.10の複素環式芳香族化合物のアミンの一種です。発煙性・息苦しい臭い刺激臭で、独特の臭いがあるので悪臭に分類されています。無色~黄色がかった液体です。
ピリジンは自然に女性からも分泌されています。ニコチンやピリドキシンなどはピリジン環を持っており、 石油や誘導体であるピリジンアルカロイドが植物にも含まれているように、天然にも存在している物質となっています。また、ピリジンの構造が含まれているビタミンB6やNADは生体内の重要な物質です。
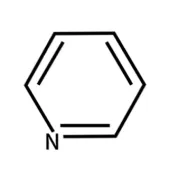
ピリジンとベンゼンの違い
| ピリジン | ベンゼン |
 |
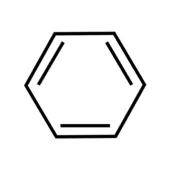 |
ベンゼンは6つのC-H構造で構成されています。ピリジンは6つのC-H構造のうち、1つだけC-HがN(窒素原子)に置き換わった構造です。
ピリジンはべンゼンと比較して、環の電子密度が減少していることから、芳香族求電子置換反応の反応性がベンゼンに比べて低くなっています。
ベンゼンは水とは混ざることがなく、油のように浮いてしまいますが、窒素が入っているピリジンは水に良く溶けます。また、ピリジンは腐敗した魚のような臭いですが、ベンゼンはガソリンのような石油系の臭いです。原子が1つ違うだけで異なる性質になります。
ピリジンの性質・特徴

| 化学式 | 分子量 | 融点 | 沸点 | 比重 | |
| ピリジン | C5H5N | 79.10 | -41.6℃ | 115.2℃ | 0.98g/cm3 |
ピリジンはベンゼンの炭素を1つだけ窒素に変えた芳香性族複素環化合物です。窒素原子はsp2混成しており、窒素原子は芳香族π共役系に 1電子を提供します。この1電子と、炭素から提供された 5電子を合わせて6電子に。ヒュッケル則を満たすため、芳香族としての性質を持ちます。
窒素の電気陰性度は炭素よりも大きいため、r 電子は窒素に引きつけられます。環の電子密度は低下し、わずかに電子不足に。ピリジンのようなπ不足系芳香族複素環では、窒素原子の非共有電子対がsp2に入っていることから塩基性を示します。さらに、電子欠乏性の芳香環で、求電子置換反応も受けにくい性質を持っています。
ピリジンの主な性質を下記にまとめました。
- 無色~黄色で臭いのある液体(腐り果てた魚のような臭い)
- 水によく溶け、溶解力が大きい
- 毒性がある
- π電子不足系ヘテロ六員環化合物に分類
また、酸化剤として知られている、クロロクロム酸ピリジニウム(PCC)の原料としても重要な役割を持っています。水・アルコール・エーテル・石油エーテル・油類・ベンゼン・クロロホルム等の多くの有機溶剤と融合できる、重要な化学原料と溶剤です。
水によく溶ける
ピリジンは無極性溶媒に溶け、極性溶媒である水にも溶けます。ピリジンの窒素原子が水と水素結合を形成し、溶媒和するためです。特に水やエタノール、ジエチルエーテルに溶けやすくなっています。
溶解力が大きい
ピリジンの窒素原子が水と水素結合をするため、溶解力が大きくなります。電気的にマイナスな窒素は、プラスに分極した水の水素原子(H)と水素結合するのです。
ピリジンの反応性

ここからはピリジンの反応性についてです。
芳香族求電子置換反応
ピリジンは電子豊富な環ですが、芳香族求電子置換反応は進行しにくくなっています。芳香族求電子置換反応は3位で反応します。反応を進めるには、高温などの厳しい条件が必要です。
反応性が低い原因の一つが、ピリジンのプロトン化。ニトロ化やスルホン化などの芳香族求電子置換反応は触媒となる酸を使用し、酸性条件で進行させることが多いです。この酸が塩基性のピリジンに含まれている窒素と反応してしまい、プロトン化します。よって環の電子密度が小さくなり反応性が低下してしまうようです。このことが、π不足系芳香族複素環での求電子置換反応の反応性が低くなる要因とされています。
芳香族求核置換反応
芳香族求電子置換反応と比較すると、芳香族求核置換反応は進行しやすくなっています。環状に正電荷が局在しており、芳香族求核置換反応は、求核剤が攻撃してベンゼン環上の置換基を置き換える反応です。ピリジンでは2位と4位で反応が起こります。
ピリジン塩酸の反応性
ピリジンは塩基性なので塩酸と反応しやすく、ピリジン塩酸塩(C5H5N-HCl)を生成。ニッケル触媒を使用、200℃・15~30MPaの環境で反応させます。水素を添加して還元反応をさせることで、ピペリジンを生成します。
ピリジンの合成方法

ピリジンの合成方法を3つ紹介します。
- Bohlman-Rahtz ピリジン合成
- チチバビンピリジン合成
- Hantzsch Dihydropyridine 合成
Bohlman-Rahtz ピリジン合成
エナミンとエチニルケトンを縮合させてできるアミノジエン中間体から脱水して環化を起こし、ピリジン環を生成する方法です。
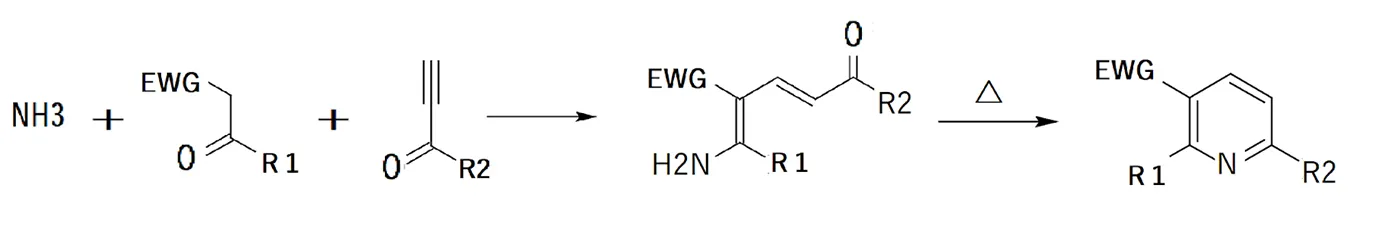
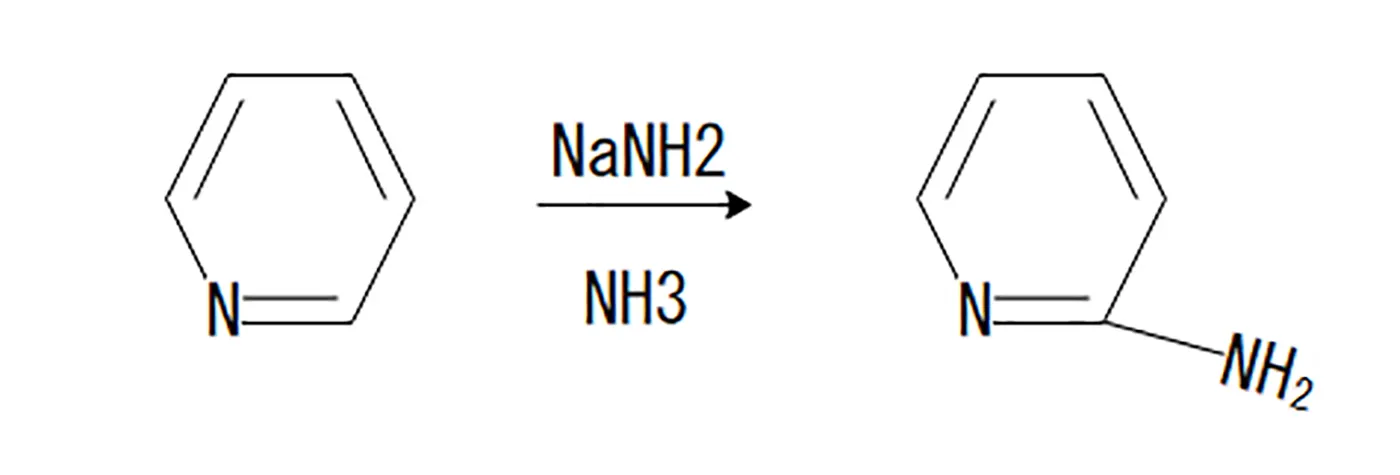
チチバビンピリジン合成
チチバビンピリジン合成は複素環形成反応の1つです。ピリジンにナトリウムアミドを加えて加熱、アンモニアを用いて反応させます。窒素の隣接位にアミンが導入された化合物ができます。
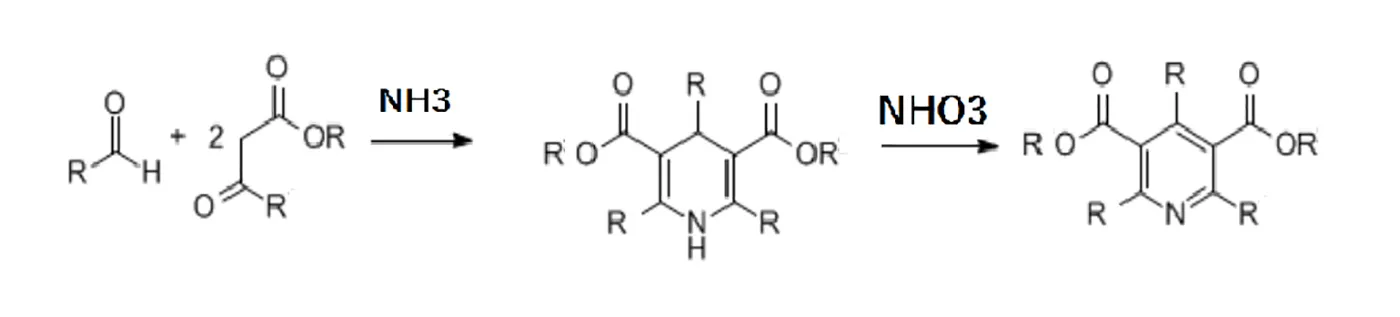
Hantzsch Dihydropyridine 合成
β-ケトエステルとアルデヒド、アンモニアを作用させ、ジヒドロピリジン誘導体の合成を行います。引き続き、酸化によって対称型多置換ピリジンへ変換し、エステル部は加水分解をして脱炭酸によって除去することが可能です。
ピリジンの主な用途

ピリジンの主な用途は何でしょうか。
| ピリジンの用途 |
|
ピリジンは主に有機合成の反応溶媒や塩基として用いられています。ピリジンに含まれている窒素原子は孤立電子対が存在しており、弱塩基性です。そのため溶媒だけでなく、求核剤としても利用できます。
また、抗菌剤であるジンクピリチオンの原料などにも使用されており、防汚剤や殺菌剤としても機能します。塗料やシャンプーなどに混ぜ合わせられているようです。
医薬品や農薬にもピリジン誘導体が使用されており、農薬に関しては急速に発展しています。ピリジンは生活して行く中で、身近で必要な物質です。
ピリジンの毒性

ピリジンの蒸気は眼や鼻の粘膜を刺激します。吸入すると咳・めまい・頭痛・吐き気・息切れ等の症状が出ます。経口摂取をしてしまうと腹痛・下痢・嘔吐・脱力感が出始め、胃腸系に何かしら影響が出る可能性が。
皮膚へは乾性・鱗状性・鞁裂性皮膚炎をひき起こします。光感作性があり、液体が直接皮膚に接触してしまうと薬傷を起こします。
消防法による危険物として、第四類の引火性液体・第一石油類(水溶性液体)に指定。一定量以上の貯蔵は消防署への届出が必要です。
人間の皮膚と接触するとメラニンと反応し、黒く色素沈着を残すので、使用する際には保護手袋での取り扱いが必要です。
まとめ
| 化学式 | 分子量 | 融点 | 沸点 | 比重 | |
| ピリジン | C5H5N | 79.10 | -41.6℃ | 115.2℃ | 0.98g/cm3 |
ピリジンは無色~黄色、臭いのある液体で水溶性があります。また、毒性があるので消防法による危険物として、第四類の引火性液体・第一石油類(水溶性液体)に指定されています。蒸気で吸い込んでしまったり、皮膚に接触してしまうと眼や鼻の粘膜を刺激したり、薬傷を引き起こします。使用する際は十分に注意を払い、保護手袋を使用してください。
ピリジンは自然に女性からも分泌されていたり、ピリジンの構造が含まれているビタミンB6やNADは生体内の重要な物質です。スルホンアミド剤や抗ヒスタミン剤など、医薬品にも含まれており、私たちの生活に身近な物質でもあります。

