塩化チオニルとは?性質や主な用途について解説
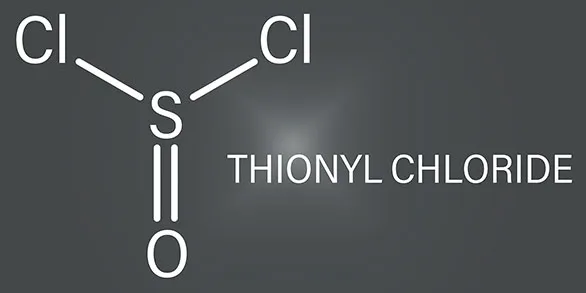
塩化チオニルとは一体どのような化合物でしょうか?塩化チオニルの性質や生成方法はもちろん、危険性や注意点を含めて紹介していきます。
また、塩化チオニルは実際にどのように使用されているのでしょうか。日頃の私たちの生活にも役に立っていることもありますよ。
塩化チオニルとは
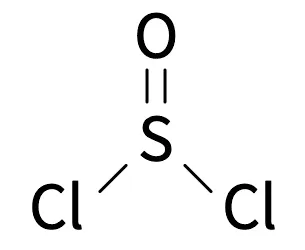
塩化チオニルは別名で『スルフィニルジクロリド(Sulfinyl Dichloride)』『オキシ塩化イオウ(Sulfurous oxychloride)』『硫黄(IV)ジクロリドオキシド(Sulfur(IV) dichloride oxide)』と呼ばれることもあります。
塩化チオニルは三角錐形の分子構造をしており、亜硫酸の酸塩化物に相当する無機化合物。発煙性や・息苦しい臭い刺激臭を伴う、無色~黄色がかった液体です。
塩化チオニルの性質
| 化学式 | 分子量 | 融点 | 沸点 | 比重 | |
| 塩化チオニル | SOCI2 | 118.97 | -104.5°C | 76°C | 1.65g/cm3 |
塩化チオニルの性質は、有機溶剤であるベンゼン・クロロホルム・四塩化炭素と混合するという特徴があります。水に対しては加水分解、激しい発熱を伴いながら反応し、塩化水素と二酸化硫黄が発生します。
塩化チオニルは液体の状態で皮膚に対しては火傷、蒸気の状態では目や粘膜を侵すといった性質を持っていることから、毒物及び劇物取締法により『劇物』に指定されています。
また、労働安全衛生法では『名称等を表示すべき危険物及び有害物』『名称等を通知すべき危険物及び有害物』にも指定されています。取り扱いには十分注意してくださいね。
塩化チオニルの反応
先ほど紹介したように、塩化チオニルは有機溶剤に溶けるが、水とは激しく反応することがわかっています。
SOCl2 + H2O → SO2 + 2HCl
化学式を見て分かるように、二酸化硫黄(亜硫酸ガス)と塩化水素(塩酸)が発生します。
塩化チオニルの製法

塩化チオニルの製法の紹介です。
SO2 + PCl5 → SOCl2 + POCl3
1つ目の塩化チオニルの製法は、二酸化硫黄と五塩化リンを反応させることで生成される塩化ホスホリルを蒸留させます。蒸留させることで塩化ホスホリルと分留でき、塩化チオニルを得られます。
S2Cl2 + Cl2 → 2SCl2
SCl2 + ClSO3H → SOCl2 + SO2 + HCl
2つ目の塩化チオニルの製法は、塩化硫黄に塩酸を加えながら、発煙硫酸やクロロスルホン酸を反応させる方法です。三塩化アンチモンを触媒にすると反応しやすくなっています。生成物を蒸留精製することで、塩化チオニルを得られます。
S2Cl2 + 2SO2 + 3Cl2 → 2SOCl2
SCl2 + SO2 + Cl2 → 4SOCl2
3つ目の塩化チオニルの製法は、塩化硫黄と亜硫酸ガスと塩素を反応させる方法です。活性炭を触媒とし、反応させることでできる生成物を蒸留精製することで、塩化チオニルを得られます。
3つの方法の中でも、3番目に紹介した『塩化硫黄と亜硫酸ガスと塩素を反応させる方法』が、高品質な塩化チオニルを得ることができます。
塩化チオニルの主な用途
塩化チオニルの製法を紹介しましたが、実際に塩化チオニルの主な用途は何でしょうか。
| 有機合成に用いられる |
|
塩化チオニルは反応後の生成物がHClやSO2などと言った、ガスであること。塩化チオニルの沸点が、76℃と低いことから、反応系外に除去することが簡単です。
塩化チオニルは、ほかの塩素化剤と比較して、取り扱いやすい・分離精製が簡単で収率が良い・高純度の製品が得られることを特徴としています。よって、農薬や医薬、染料などの高分子化合物の分野での中間体の原料として用いられています。
| 私たちの生活に用いられる |
|
塩化チオニルリチウム電池は、電力・ガス・水道メーター用電源・メモリICのバックアップ用・エレクトロニクス機器電源など幅広く使用されており、生活にかかせないものとなっています。
塩化チオニルのつぶし方
塩化チオニルはアルカリ処理法です。アルカリ処理法とは、大量のアルカリ水溶液(水酸化カルシウム・水酸化ナトリウム・炭酸ナトリウムなど)に攪拌します。
攪拌時には、発熱と水溶液が飛ばないように注意が必要です。アルカリ水溶液を少しずつ加えながら徐々に加水分解させ、希硫酸を加えて中和していきます。
塩化チオニルの危険性

塩化チオニルは、液体や蒸気の状態で皮膚や粘膜を侵すといった性質をもっており、有毒な物質です。
| 症状 | |
| 吸入 | 咽頭痛・咳・灼熱感・息切れ・息苦しさ |
| 皮膚に付着 | 痛み・発赤・重度の皮膚熱傷 |
| 眼に入る | 痛み・発赤・重度の熱傷 |
| 飲み込む | 灼熱感・腹痛・ショック・虚脱 |
もし、塩化チオニルが衣類や皮膚に付着してしまった場合は、医師に連絡し、すぐに大量の水で洗い流す必要があります。眼に入った場合も直ちに流水で十分に洗眼しましょう。飲み込んでしまった場合は、無理に吐くことはやめてください。
塩化チオニルを使用する際には、ゴム手袋と保護メガネを必ず着用しましょう。吸入の恐れのある場合は塩素用簡易保護マスクを着用してください。
塩化チオニルの注意点

容器を密閉し、湿気や直射日光を避けて換気の良い冷暗所に施錠して保管するようにしましょう。
塩化チオニル自体には腐食性が無いので、ステンレス銅・鉄・アルミニウムなどの金属を侵すことはありません。しかし、水分に触れてしまうと加水分解を起こし、激しく反応することで腐食性の強い塩酸が生成されます。
塩酸によって金属は腐食してしまうので、塩化チオニルの保管・取り扱いには、水分や空気中の湿気との接触は極力避けてください。
塩化チオニルの熱分解
塩化チオニルは熱分解によって、塩素・二酸化硫黄・二塩化二硫黄を生成。塩化チオニルの沸点以上の140℃ 以上に加熱することで熱分解が起こり始め、 500℃で完全に分解します。
4SOCl2 → 2SO2 + 2Cl2 + S2Cl2
塩化チオニルの後処理

後処理・廃棄においては、関連法規と地方自治体の基準に従ってください。
都道府県知事などの許可を受けた産業廃棄物処理業者や地方公共団体が処理を行っている場合はそこに委託して処理をします。廃棄物の処理を委託する場合は、処理業者等に危険性や有害性を十分告知してください。
また、アルカリ処理法で塩化チオニルを中和させる必要があります。『塩化チオニルのつぶし方』を参照してください。
包装容器は清浄にしてリサイクル、基準に従って適切な処分を行います。空容器を廃棄する場合は、内容物を完全に除去することが必要です。
まとめ
塩化チオニルは、三角錐形の分子構造をしており、亜硫酸の酸塩化物に相当する無機化合物です。無色~黄色がかった液体で、発煙性や・息苦しい臭いを伴います。
| 化学式 | 分子量 | 融点 | 沸点 | 比重 | |
| 塩化チオニル | SOCI2 | 118.97 | -104.5°C | 76°C | 1.65g/cm3 |
- ベンゼン・クロロホルム・四塩化炭素などの有機溶媒には可溶
- 水とは激しい加水分解を起こし、発熱を伴いながら塩化水素と二酸化硫黄を発生
- 皮膚に対して火傷、蒸気の状態では目や粘膜を侵す
高品質な塩化チオニルを得ることができる製法は、活性炭を触媒とし、塩化硫黄と亜硫酸ガスと塩素を反応させる方法です。
S2Cl2 + 2SO2 + 3Cl2 → 2SOCl2
SCl2 + SO2 + Cl2 → 4SOCl2
反応でできた生成物を蒸留精製すると塩化チオニルを得られます。
また、塩化チオニルには、さまざまな用途があります。
- 農薬や医薬、染料などの高分子化合物の分野での中間体の原料
- 塩化チオニルリチウム電池の正極活物質
上記のように、塩化チオニルは、私たちの生活に欠かせない物質です。

